El osteosarcoma es un tumor maligno compuesto de células fusiformes, que se caracteriza por la producción de tejido osteoide y hueso, su crecimiento es rápido con extensión locoregional y difusión metastásica a pulmón. Generalmente 20% de los pacientes presentan metástasis en el momento del diagnóstico. Se observa con frecuencia en los huesos largos de los adolescentes y adultos jóvenes con mayor afectación del sexo masculino. El tratamiento de los pacientes con osteosarcomas se basa en la resección amplia y completa o en una amputación del tumor primario, y en la administración de quimioterapia coadyuvante. Presentamos el caso de paciente masculino de 21 años, quien consultó por una tumoración en la rodilla izquierda de rápido crecimiento hasta alcanzar 80 cms de perímetro. La biopsia incisional reportó un condrosarcoma condroblástico. En vista de no tener respuesta al tratamiento coadyuvante, se decidió realizar una desarticulación coxofemoral. Cuando el osteosarcoma es resistente a la quimioterapia y su crecimiento continúa, se deben realizar procedimientos radicales para garantizar la sobrevida del paciente.
Palabras clave: Osteosarcoma Condroblástico, Osteosarcoma, Neoplasias Oseas, Metástasis de la Neoplasia, Quimioterapia, Oncología Ortopédica.
Osteosarcoma is a malignant tumor composed of spindle cells, characterized by the production of osteoid tissue and bone is growing rapidly, with locoregional extension and metastatic spread to the lung. Generally 20% of patients have metastases at diagnosis. It most often occurs in the long bones of adolescents and young adults with greater male involvement. Treating osteosarcoma patients is based on wide and complete resection or amputation of the primary tumor and the administration of adjuvant chemotherapy. We present the case of male patient 21, who presented a tumor in his left knee rapidly growing up to 80 cm in circumference. Incisional biopsy chondroblastic reported chondrosarcoma. In view of having no adjuvant treatment response was decided to hip disarticulation. When osteosarcoma is resistant to chemotherapy and growth continues, radical procedures must be performed to ensure the survival of the patient.
Key words: Osteosarcoma Chondroblastic, Osteosarcoma, Bone Neoplasms, Neoplasm Metastasis, Drug Therapy, Orthopedic Oncology.
El osteosarcoma es un tumor maligno, compuesto de células fusiformes, que se caracteriza por la producción de tejido osteoide y hueso. Aunque es un tumor muy raro, es el sarcoma más frecuente en el niño y el adolescente. Su causa es desconocida, aunque hay evidencias que lo relacionan con ciertas anormalidades genéticas. Se han encontrado mutaciones del gen RB1 en el cromosoma 13q en el 60-70% y mutaciones del gen p53 en el cromosoma 17, por lo menos, en el 30 al 35% de los ellos(1-5).
Se presenta con mayor frecuencia en el sexo masculino y personas de raza negra, y tiene una frecuencia bimodal, con un pico de mayor incidencia en la adolescencia y otro después de los 65 años de edad. La localización más frecuente es la metáfisis de los huesos largos y se ha calculado que alrededor de la mitad de los casos se localizan en la región de la rodilla. Los sitios más comunes de aparición son, en orden de frecuencia: fémur distal, tibia proximal, húmero proximal, diáfisis y fémur proximal, pelvis y otros huesos(5-7).
La mayoría de los pacientes consultan por dolor localizado y progresivo de varios meses de evolución y generalmente refieren antecedente de algún tipo de traumatismo. Al examen físico se puede palpar una gran masa dolorosa que compromete las partes blandas, localizada en las región metafisiaria(5,8,9).
El riesgo de presentar una fractura patológica antes de hacer el diagnóstico, como en el curso de la administración de la quimioterapia preoperatoria, es de un 5 a 10%. Los signos tardíos de la enfermedad incluyen: pérdida de peso, fiebre y compromiso del estado general(10). En la zona afectada el aumento de volumen ocasiona la aparición de estrías y red venosa colateral, limitando la movilidad de la extremidad afectada (8).
El tumor primario debe ser evaluado inicialmente mediante radiografía convencional en dos planos, sin embargo, la resonancia magnética (RM) es superior a la tomografía computarizada (TC) para evaluar la extensión de las partes blandas, paquetes vasculonerviosos, afectación articular, médula ósea y metástasis saltatorias. Por otro lado, la TC es superior para detectar metástasis pulmonares y debe ser realizada en todo paciente con diagnóstico de osteosarcoma. No obstante, la biopsia abierta constituye el gold standard en el diagnóstico definitivo(1,5,11).
Existen varios tipos de osteosarcoma, de acuerdo a sus características clínicas, radiográficas e histológicas; el grupo principal lo constituyen los osteosarcomas convencionales, que es el tipo histológico más frecuente y comprende cerca del 90% de todos los osteosarcomas. Según el componente celular predominante, se subdivide en osteoblástico (50%), condroblástico (25%) y fibroblástico (25%)(1-5).
Ahora bien, el tratamiento del osteosarcoma ha evolucionado de forma progesiva en las últimas décadas, gracias a los avances en la quimioterapia antineoplásica. Actualmente y con los adelantos quirúrgicos y reconstructivos, es muy poco frecuente ver pacientes que sean tratados de forma primaria mediante la amputación de la extremidad afectada, sin embargo, este procedimiento tiene hoy en día indicaciones muy precisas.
Presentamos el caso de paciente masculino de 21 años, quien consultó por una tumoración en la rodilla izquierda de rápido crecimiento, hasta lograr alcanzar 80 cm de perímetro lesional.
Se trata de paciente masculino, de 20 años de edad, natural y procedente de Chachopo, Estado Mérida, Venezuela, quien inicia su enfermedad actual en enero del 2012, caracterizado por aumento progresivo de volumen de la rodilla izquierda a expensas de masa dura y redondeada, acompañado de dolor de moderada intensidad, tanto en actividad como en reposo.
El paciente refiere pérdida de peso de 10 kg de enero a agosto, tinte ictérico en piel y mucosas y debilidad muscular generalizada. Al examen físico se evidencia aumento de volumen en tercio distal del muslo izquierdo a expensas de masa redondeada, dolor, deformidad y cambios de temperatura y coloración, con compromiso en arcos de movilidad de la rodilla izquierda.
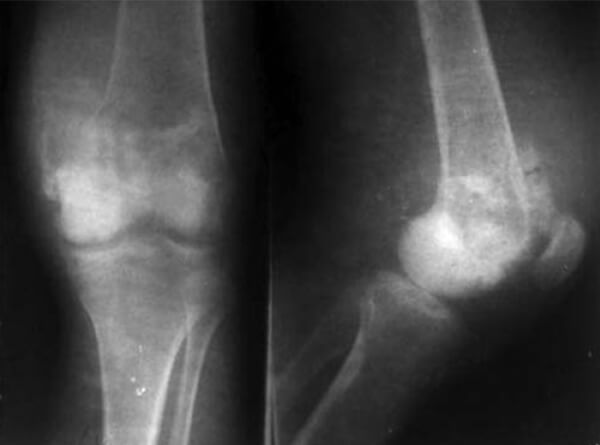
Se evidenció elevación de la LDH en 363.7 UI/L y de la fosfatasa alcalina en 295 U/L. Los estudios radiográficos de la rodilla en sus proyecciones anteroposterior (AP) y lateral, evidencian una lesión agresiva en la porción metafisiaria del fémur distal, con áreas radiodensas y radiotransparentes, con formación de hueso nuevo perióstico y levantamiento de cortical (ver Figura N° 1). En la Tomografía Computarizada (TC) de tórax así como en el gammagrama óseo, no se evidenciaron metástasis a distancia.
Se trata de paciente masculino, de 20 años de edad, natural y procedente de Chachopo, Estado Mérida, Venezuela, quien inicia su enfermedad actual en enero del 2012, caracterizado por aumento progresivo de volumen de la rodilla izquierda a expensas de masa dura y redondeada, acompañado de dolor de moderada intensidad, tanto en actividad como en reposo.
El paciente refiere pérdida de peso de 10 kg de enero a agosto, tinte ictérico en piel y mucosas y debilidad muscular generalizada. Al examen físico se evidencia aumento de volumen en tercio distal del muslo izquierdo a expensas de masa redondeada, dolor, deformidad y cambios de temperatura y coloración, con compromiso en arcos de movilidad de la rodilla izquierda.
Se evidenció elevación de la LDH en 363.7 UI/L y de la fosfatasa alcalina en 295 U/L. Los estudios radiográficos de la rodilla en sus proyecciones anteroposterior (AP) y lateral, evidencian una lesión agresiva en la porción metafisiaria del fémur distal, con áreas radiodensas y radiotransparentes, con formación de hueso nuevo perióstico y levantamiento de cortical (ver Figura N° 1). En la Tomografía Computarizada (TC) de tórax así como en el gammagrama óseo, no se evidenciaron metástasis a distancia.
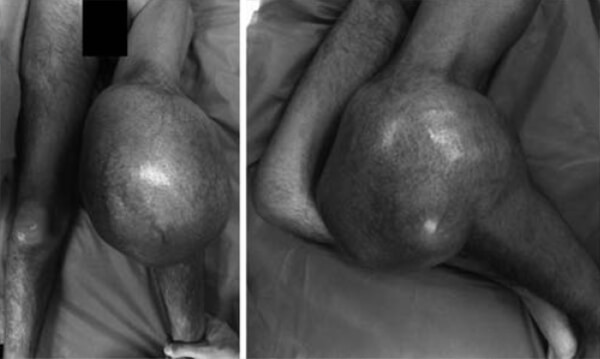
Se realizó biopsia incisional que reportó, “células osteoblásticas productoras de matriz osteoide y tejido condroblástico” (*) hallazgos histopatológicos compatibles con un osteosarcoma condroblástico de alto grado. El paciente es valorado y tratado por el servicio de oncología médica y recibió 10 ciclos de quimioterapia con Ifosfamida, Mesna y Dox durante 3 meses, sin embargo, no tiene respuesta al tratamiento y es revalorado por nuestro servicio. En este momento la tumoración ha alcanzado 80 centímetros de perímetro (ver Figura N° 2).
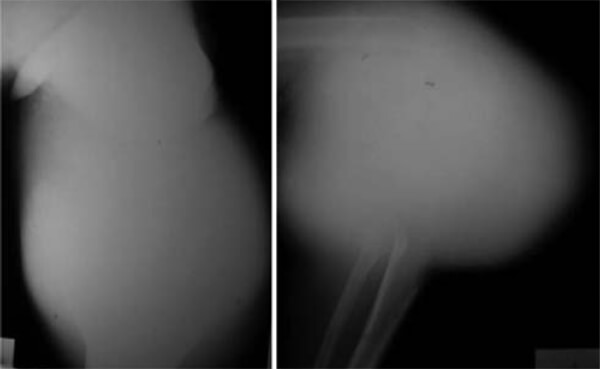
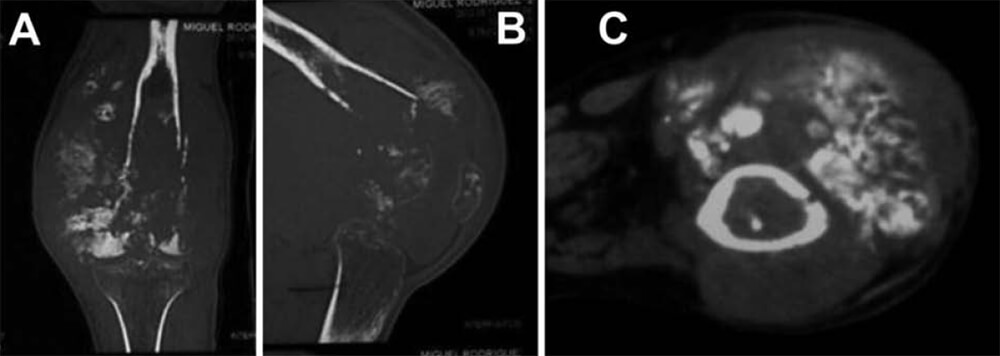
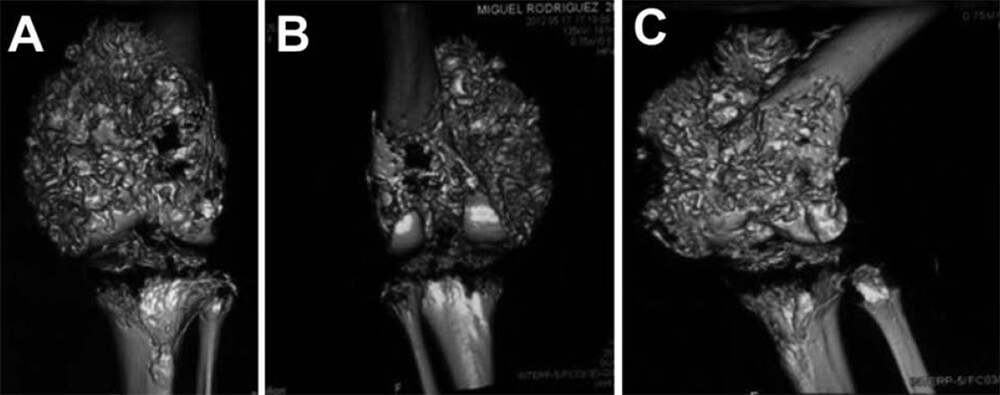
Radiológicamente, se evidencia importante destrucción ósea con opacidades algonodosas de hueso tumoral, reacción perióstica agresiva y masa tumoral en partes blandas, con la característica imagen en “sol radiante” (ver Figura N° 3). Se realiza TC donde se evidencia la extensión de la lesión (ver Figuras N° 4 y N° 5).
Al considerar el tipo de lesión histológica, el crecimiento rápido, la severa invasión a las partes blandas que imposibilitó la realización de algún tipo de cirugía de salvamento, se realizó la desarticulación a nivel de la cadera (ver Figura N° 6), seguido de quimioterapia postoperatoria y valoración directa con el especialista en oncología médica.

Al examen de la masa tumoral, se comprobó que el grado de necrosis causado por la quimioterapia preoperatoria fue solo del 85%. A 6 meses del postoperatorio, no se han evidenciado metástasis óseas o pulmonares.
El tratamiento del osteosarcoma ha evolucionado de forma importante en los últimos 30 años. Con la introducción de la quimioterapia adyuvante, que permitió aumentar la sobrevida de los paciente y aumentar sus posibilidades de conservar las extremidades, el tratamiento evolucionó, desde la amputación o cirugía radical, como única modalidad terapéutica, hacia los procedimientos preservadores y reconstructivos(1,2,5,12).
Antes de la era de la quimioterapia adyuvante, la sobrevida en pacientes con tumores resecables era de 15 a 20% a cinco años, con un índice de mortalidad del 75 al 85%. Actualmente, la sobrevida se ha incrementado hasta un 75% a los 5 años, y aproximadamente el 80% de los pacientes con osteosarcomas en las extremidades son candidatos a cirugías preservadoras y reconstructivas. Estos procedimientos y su combinación con la quimioterapia adyuvante se han convertido en el estándar de tratamiento(12-14).
Es de suma importancia elegir el tratamiento adecuado para estos pacientes ya que la intervención quirúrgica nunca debe poner en peligro el criterio oncológico (16). Uno de los factores que se toman en cuenta a la hora de decidir entre una cirugía preservadora, reconstructiva o radical, es el tamaño del tumor. Cuando el volumen tumoral absoluto es mayor a 70 cm3, se asocia con período libre de enfermedad del 87% y los tumores mayores a 150 cm3 con 58% de período libre de enfermedad (14).
El procedimiento adecuado para cada paciente se elegirá de acuerdo a su edad, defecto, experiencia del equipo quirúrgico y de las necesidades del paciente. De forma general, el tumor debe ser resecado con zonas de seguridad amplias, tal y como fueron descritas por Enneking(17) como resección amplia, esto se puede alcanzar, mediante la cirugía preservadora, amputación o desarticulación(18). Las contraindicaciones de la cirugía preservadora se encuentran resumidas en la Tabla N° 1.

En nuestro caso, al considerar el tipo de lesión histológica, su rápido crecimiento, el compromiso severo de las partes blandas y la resistencia al tratamiento adyuvante pre operatorio, se decidió realizar el tratamiento radical.
El porcentaje de necrosis tumoral obtenido durante la quimioterapia neoadyuvante, la existencia o no de metástasis pulmonares al momento de hacer el diagnóstico, así como también el haber logrado márgenes quirúrgicos negativos durante el procedimiento elegido, son los elementos pronósticos principales para estos pacientes (1,2,4,5,8,10,12,15,18).
En conclusión, nos encontramos ante un caso interesante, donde el manejo multidisciplinario, entre los servicios de oncología médica, quirúrgica y ortopédica, permitió tomar la decisión terapéutica adecuada sin sacrificar el criterio oncológico.