La densitometría a doble fotón (DXA) es un método de utilidad para determinar la densidad mineral ósea (DMO) de columna y cadera y de manera especial el tejido esponjoso, y tiene un papel determinante para evaluar el paciente en riesgo de tener una osteoporosis y así escoger la terapia más adecuada para tratar este problema. Con el transcurrir de los años se ha intentado utilizar este procedimiento para estudiar otras posibilidades como la osteointegracion de las artroplastias o las características del tejido cortical. El objetivo de esta revisión es poner, en el tapete de discusión, la utilidad de este método en el estudio de las patologías ortopédicas, de manera especial en la consolidación y la osteointegracion de los implantes y que de alguna manera forme parte de las ayudas paraclínicas del cirujano ortopedista.
Palabras clave: Densitometría, Osteointegración, Consolidación, Osteoporosis
Nivel de evidencia: II
The two-photon densitometry (DXA) is a useful method to determine the bone mineral density(BMD) of spine and hip, especially the trabecular tissue, and has a key role to assess the patient at risk for osteoporosis and thus choose the most appropriate therapy for this problem. With the passing of the years have tried to use this method to study other possibilities as osseointegration of arthroplasties or characteristics of the cortical tissue. The aim of this review is to put on the table for discussion, the usefulness of this method in the study of orthopedic pathologies, especially in the consolidation and osseointegration of implants and somehow part of the paraclinical aid the orthopedic surgeon.
Key words: Densitometry, Osseointegration, Consolidation, Osteoporosis.
El tejido óseo tiene propiedades mecánicas representadas por la dureza, elasticidad y rigidez. Ellas varían en función de la edad, sexo, raza, estado general de salud, masa muscular y nivel de actividad. Los huesos están adaptados para su función con distintas fortalezas, determinadas por la masa, la cual está asociada a las propiedades materiales y estructurales de sus componentes e influenciada por la remodelación, es lo que se conoce como calidad ósea. Las propiedades estructurales, que afectan la fortaleza, incluyen la geometría, la micro arquitectura (red trabecular, grosor cortical y su porosidad), las características de la matriz de colágeno, el mineral y la extensión del micro daño(1).
Cuando un peso es aplicado, a nivel del hueso que posee una mineralización envejecida, se forman los microdaños, punto de partida para el inicio del proceso fisiológico de la remodelación; pero si son muchos, se acumulan y se predispone a las fracturas por fatiga. La mayoría de los aspectos de la fortaleza ósea pueden ser influenciados por la remodelación y la mineralización. El imbalance de la remodelación afecta la micro arquitectura trabecular y cortical, por tanto el incremento de la resorción es factor de riesgo para fracturas(2).
Para las propiedades materiales del tejido óseo se consideran determinantes de importancia, la densidad mineral ósea (DMO), la resistencia y la calidad. La matriz del hueso se compone de un material compuesto, el mineral que proporciona la rigidez y las fibras de colágeno la resistencia a la tracción, ductilidad y tenacidad(3).
La osteoporosis posmenopáusica es una condición crónica que se caracteriza por una disminución de la masa ósea y deterioro de la micro arquitectura del hueso que compromete la resistencia, por lo tanto, predispone a las mujeres a las fracturas por fragilidad, una causa importante de morbilidad y mortalidad. La osteoporosis es ampliamente reconocida como un problema de salud pública debido a la morbilidad, la mortalidad y los costos asociados con sus complicaciones, es decir, las fracturas de la cadera, columna vertebral, antebrazo y otros lugares del esqueleto. El único estudio que la Organización Mundial de la Salud acepta para su diagnóstico es la densitometría a doble fotón (DXA). La incidencia de fracturas por fragilidad, secundaria a la osteoporosis, es mayor en las ancianas y se acepta de acuerdo a la epidemiología que una de cada dos mujeres la sufren(4).
Las fracturas se producen cuando la fuerza aplicada al hueso excede su capacidad de carga. La osteoporosis causa una reducción en la resistencia a la compresión y de manera normal aumenta el riesgo de fractura tanto en el esqueleto axial como en el apendicular(5).
El ortopedista de manera frecuente, se enfrenta a problemas específicos, como retraso de consolidación y los aflojamientos asépticos relacionados con los procedimientos para el manejo de las fracturas o la colocación de implantes que sustituyan las articulaciones. En esta revisión, se hará un enfoque del papel de la DXA en el diagnostico precoz de ambos problemas, o de la evolución, luego de efectuar la terapéutica.
La mayoría de las fracturas consolidan en un periodo normal, pero entre un 5% al 10% no cicatrizan y se consideran como retardo o no unión (seudoartrosis). Para la evaluación de la evolución de ellas, el estudio radiológico es fundamental y existe diversidad de clasificaciones para seguirla. En lo que respecta, al aflojamiento aséptico, para el ortopedista es fundamental diferenciarlo de un proceso infeccioso y así poder elegir mejor la pauta terapéutica(6).
La técnica estándar de oro para la estimación de la Densidad Mineral Ósea (DMO) es la DXA debido a su reproducibilidad, naturaleza no invasiva, poco requerimiento de tiempo para el procedimiento, y la mínima exposición a la radiación. En la actualidad, máquinas de DXA, fabricadas por Hologic® y Lunar®, están disponibles para evaluar la DMO. El densitómetro Hologic® utiliza tecnología de haz en abanico, mientras que el Lunar ® utiliza haz de lápiz. Con la disponibilidad de estas máquinas y el aumento de la conciencia sobre la salud ósea, la medición de la DMO se ha vuelto común en las grandes ciudades. Es de imperiosa necesidad que los ortopedistas se involucren más en la interpretación de este estudio para valorar la densidad mineral ósea y las diferentes patologías del tejido esquelético(7).
La Organización Mundial de la Salud (OMS) introdujo un sistema de clasificación de los individuos como normal, osteopenia u osteoporosis con la DMO medida por DXA, la cual ha demostrado ser una herramienta clínica valiosa, ya que identifica a las personas en riesgo de fractura, y se ha demostrado que el tratamiento de los hombres y las mujeres con DMO baja reduce el riesgo de fracturas(8,-9).
Evaluación tridimensional no invasiva de la micro arquitectura trabecular ha sido posible mediante técnicas de imagen de alta resolución, tales como la tomografía computarizada cuantitativa periférica (pQCT ) y la resonancia magnética microscópica (μMRI), pero no están disponibles en el país(10).
El procedimiento quirúrgico para resolver la mayoría de las patología osteo-articulares, como la artrosis o las fracturas del fémur proximal, es la sustitución total, con implantes diseñados para tal fin. Las artroplastias han representado un aporte de importancia en la solución de las artropatías dolorosas que incapacitan: pero, la persistencia del dolor, entre el 30% y 50%(11) luego, de realizar esta intervención, obliga a tratar de determinar el origen que de alguna manera se ha dividido en tres modalidades: por aflojamiento séptico, no séptico y de origen desconocido(12). Para la de origen desconocido se ha propuesto el nombre de “Prótesis dolorosas”(13).
La remodelación ósea alrededor de las prótesis de cadera parece variar de acuerdo al método de fijación y su diseños(13). Incluso con el mismo implante, los investigadores han informado de una variedad de cambios de la densidad mineral ósea (DMO). En la investigación de implantes, los resultados de BMD son más a menudo dado en porcentaje de cambio con respecto a la primera medición postoperatoria(14). Los estudios de los implantes deben tener protocolo evolutivo similar para poder concluir de manera uniforme cual podría ser el factor que predispuso al aflojamiento .No se sabe con certeza si la pérdida de masa ósea se inicia de manera inmediata después de la operación o de unas pocas semanas. En el postoperatorio, la DMO podría cambiar a causa de falta de uso, atrofia, o por el trauma ósea. La hipótesis de que hay una rápida pérdida de masa ósea en los primeros días después de la operación, sería una importante fuente de sesgo para mediciones de referencia. Es de importancia recordar que durante la cirugía, el hueso proximal es eliminado y compactado y se ha estimado que la primera etapa de consolidación culmina alrededor de los 21 días, se debe recomendar que la primera medición, se inicie a partir de este momento para evitar influencias en los resultados posteriores(15-17).
La densidad mineral ósea (DMO) medida por DXA, se correlaciona con la fortaleza del hueso para determinar el riesgo de fractura, en enfermedades que la alteran, como la osteoporosis, osteopetrosis, osteogénesis imperfecta, osteomalacia, etc. El problema está en la probabilidad de fracturas, asociada a la presencia y severidad, de las anomalías del tejido óseo(18-20).
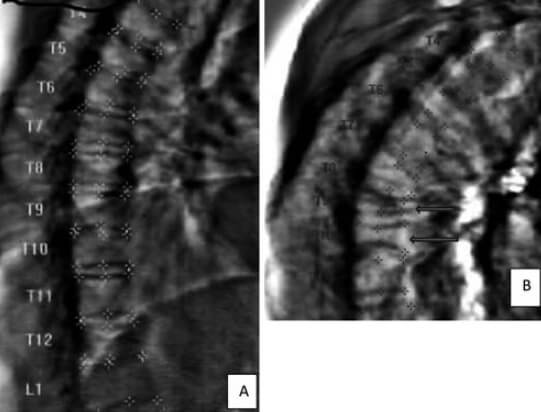
Es de uso frecuente la determinación de fracturas a nivel de la columna toraco-lumbar con la morfometria vertebral, procedimiento que debería ser usado de rutina por los ortopedistas que se dedican a esta subespecialidad (ver Figura N° 1)(21).
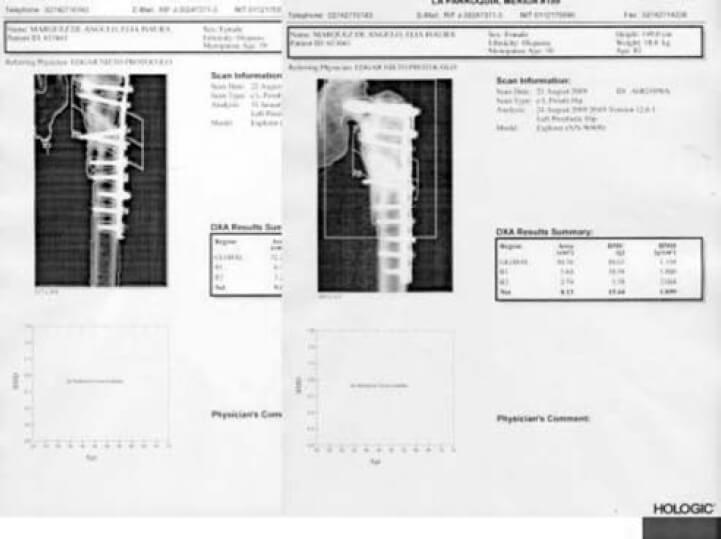
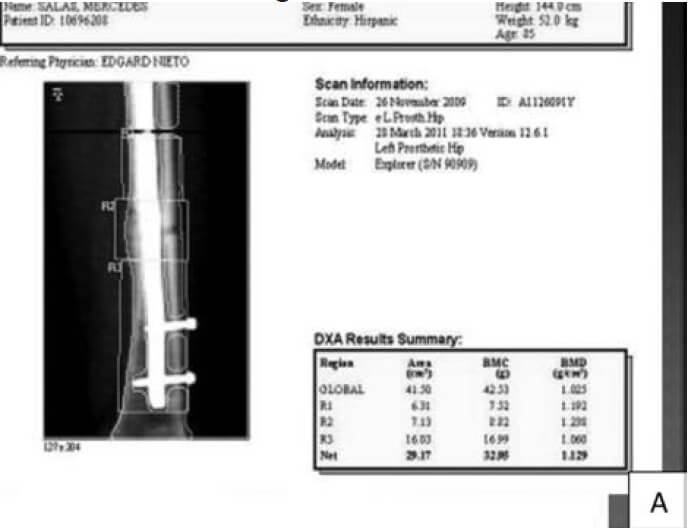
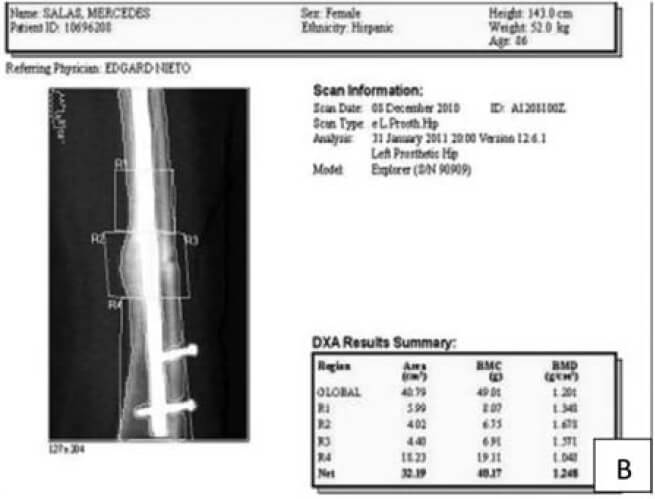
Los defectos alrededor de los implantes son difíciles de detectar de manera precoz y la cantidad de pérdida ósea, no es estimada, sino hasta muy tarde en estudios radiológicos, para algunos cuando ya existe un déficit de más del 30%. La importancia de la DXA es para evaluar el incremento del remodelado óseo y la capacidad de osteointegración en los alrededores de implantes intra o extra medulares, cuyas mediciones se deben realizar antes de la colocación del implante para valorar la calidad del hueso y después para controlar los cambios en la vecindad del tejido implantado o en los huesos distales afectados por cambios en la disposición de la carga de peso. La DXA para evaluar el aflojamiento peri protésico ha sido utilizada desde 1993 y cada día se evidencian más reportes de su utilidad para valorar los componentes acetabular, vástago y los de las prótesis de rodilla. En el caso particular de la cadera se cuenta con un software procedente del estudio de Gruen, que divide el fémur proximal en siete(7) zonas. Diversos estudios clínicos reportan con esta metodología la evolución a los 3, 5 y 10 años con diferentes diseños de prótesis y de su cubrimiento. Mejoras en el software y en la tecnología han hecho de la DXA un instrumento válido para proporcionar una medida adecuada de la DMO peri protésica y su osteointegracion (ver Figura N° 2) (22-26).
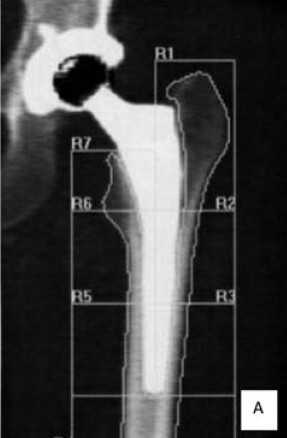
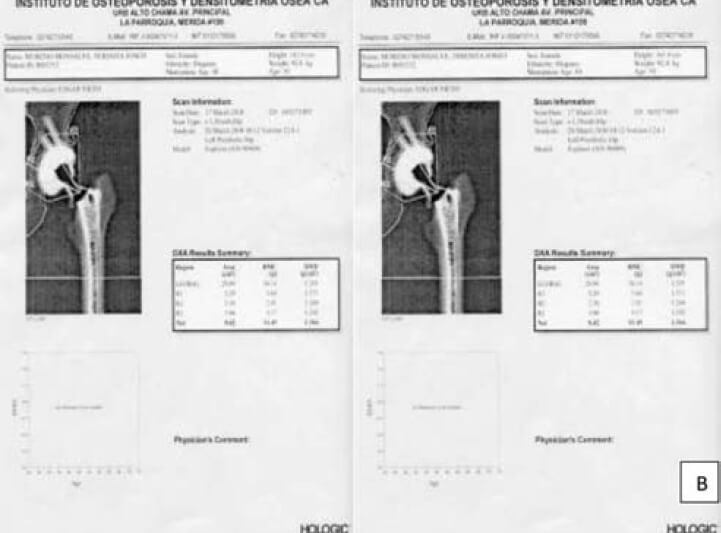
En este momento, la DXA, se considera un método útil para evaluar la redistribución de las fuerzas mecánicas alrededor de la cadera luego del implante y la remodelación alrededor del vástago, independientemente de la geometría y el cubrimiento. La mayoría de los estudios con DXA han carecido de seguimiento de más de 5 años, y muchos han utilizado el fémur opuesto como el control en el momento de la investigación. Tres años después de la artroplastia se pierde el 40% del contenido mineral óseo promedio en el trocánter menor (zona 7), y 28% en las zonas 5 y 6 de la corteza medial. A los 14 años, después de la operación se había perdido el 40% de hueso proximal y 49% distal. Los datos sugieren que la progresión es mayor hacia distal y medial(27, 28).
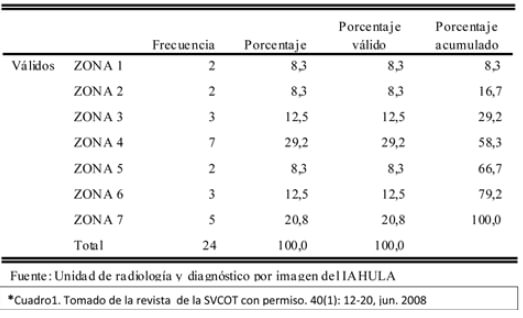
De esta manera la DXA es útil porque permite la cuantificación, en etapas tempranas, de la perdida de hueso alrededor del implante. En varios estudios, las alteraciones de la corteza de la zona medial femoral (Zona 7) se mantienen y se agravan con el tiempo. Este cambio áreal alterará las mediciones de densidad ósea. Tal y como se muestra en la tabla de trabajo realizado a 24 pacientes del IAHULA de Mérida, Venezuela luego de colocarle artroplastia no cementada en la cadera, las zonas más afectadas eran la 4 y la 7 (ver Cuadro N°1)(29).
En estudio posterior, luego de artroplastia asociado a un antiresortivos (ácido Zoledronico) comparado con suplementos se encontró que en el fémur proximal, el aumento de la DMO promedio fue de 0,52% en el grupo de sólo calcio + D, mientras que en el grupo tratado con ácido zoledrónico el aumento fue del 3,17%. Disminución de la zona VII de Gruen -1,46% en el grupo zoledrónico , mientras que en el calcio D disminución en la zona de Gruen I -2,42% y en la zona VII -3,11(30).
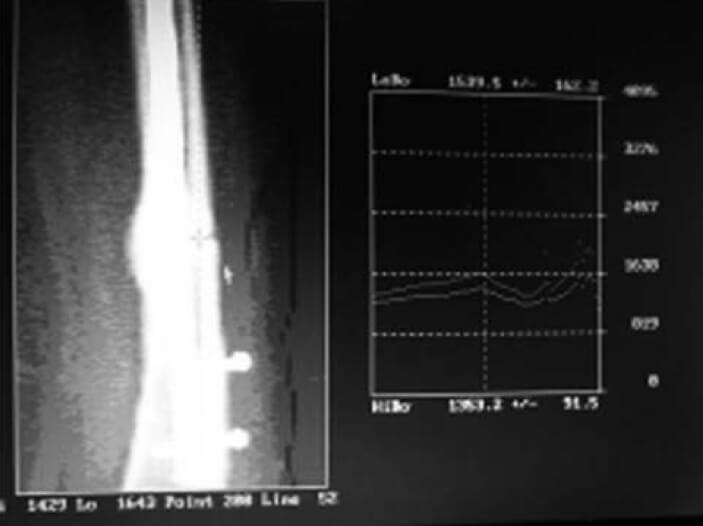
Su utilidad puede llegar hasta evaluar la consolidación ósea y la utilidad de los medicamentos de los procedimientos operatorios o de ambos.En casos de alteración de la consolidación es factible, con la utilización de software diseñados para tal fin, determinar el incremento del callo óseo en ambas corticales (ver Figuras N° 3, N°4 y N° 5)(31-34).