El Sarcoma de Ewing es un tumor óseo primitivo maligno que fue descrito por Ewing en 1921. Representa aproximadamente el 5% de todas las neoplasias malignas del hueso. Tiene el pronóstico menos favorable de todas las neoplasias malignas del hueso. Desde finales de los años 70 se han desarrollado técnicas de salvataje, con la finalidad de preservar la vida, limitar el daño, mantener la funcionalidad en la medida de lo posible y optimizar la calidad de vida evitando al máximo las complicaciones. La reconstrucción del húmero, posterior a resecciones amplias, es un reto. Presentamos el caso de paciente masculino de 7 años, portador de Sarcoma de Ewing en el húmero el cual fue tratado con resección en bloque extensa del húmero y reconstrucción con aloinjerto masivo de tibia. Presentamos su manejo y evolución a largo plazo.
Palabras clave: Sarcoma de Ewing, Tumor Neuroectodérmico Primitivo, Neoplasias, Procedimientos Ortopédicos.
NIVEL DE EVIDENCIA: V
Ewing´s Sarcoma is a malignant bone tumor that was first describe by Ewing in 1921. Represents about 5% of all malignant neoplasms of bone. Have the least favorable prognosis of all malignancies of bone. Since the late 70s salvage techniques have been developed, in order to preserve life, limit damage, maintain functionality as far as possible and optimize quality of life posible with minimal complications. Therefore, the reconstruction of the posterior humeral wide resections still challenging. We present the case of 7 years old male patient, with Ewing´s Sarcoma in the humerus which was treated with wide resection and reconstruction humeral block with massive tibia bone allograft. We present handling and long-term evolution.
Key words: Ewing’s Sarcoma, Primitive Neuroectodermal Tumors, Neoplasms, Orthopedic Procedures.
Instituciones que apoyan este trabajo:
El “Sarcoma de Ewing” (SE) es un tumor óseo primitivo maligno que fue descrito por Ewing en 1921 (1). Es un tumor formado por un acúmulo denso de células pequeñas y redondeadas, con núcleos redondos, y sin características distintivas en su citoplasma, correspondiente a una forma pobremente diferenciada del Tumor Primitivo Neuroectodérmico (TPNE) (2,3).
Representa aproximadamente el 5% de todas las neoplasias malignas del hueso (2). Tiene un pico de incidencia en la segunda década de la vida, sin embargo, se ha reportado en todos los grupos etarios, con predominio en el sexo masculino y excepcionalmente aparece en pacientes de raza negra (3,5). El SE tiene el pronóstico menos favorable de todas las neoplasias malignas del hueso (2,4).
Desde finales de los años 70, la cirugía preservadora ha reemplazado a la amputación en el tratamiento quirúrgico de los sarcomas del hueso. La aparición de agentes coadyuvantes de quimioterapia, progreso en la imagenología y desarrollo de nuevas técnicas quirúrgicas se encuentran detrás del avance de las técnicas quirúrgicas preservadoras (2,4-7).
Ahora bien, con respecto al tratamiento quirúrgico, como alternativa a la amputación de la extremidad afectada, se han desarrollado técnicas de salvataje, con la finalidad de preservar la vida, limitar el daño, mantener la funcionalidad en la medida de lo posible y optimizar la calidad de vida evitando al máximo las complicaciones (4,5,7).
Sin embargo la reconstrucción del húmero, posterior a resecciones amplias, es un reto.
Presentamos el caso de paciente masculino de 7 años, portador de SE en el húmero el cual fue tratado con resección en bloque extensa del húmero y reconstrucción con aloinjerto masivo de tibia. Presentamos su manejo y evolución a largo plazo.
Paciente masculino de 7 años, natural y procedente de la localidad de Santo Domingo, Estado Mérida, Venezuela, el cual inicia su enfermedad actual en enero de 2007 al consultar por tumoración en el brazo izquierdo de 1 mes de evolución.
No refiere antecedentes de importancia. Al examen físico de ingreso se evidencia tumoración en el tercio medio con proximal del brazo izquierdo, de localización anterolateral, dolorosa a la palpación y de consistencia dura. Concomitantemente se encontró ginecomastia puberal grado III de Simons.
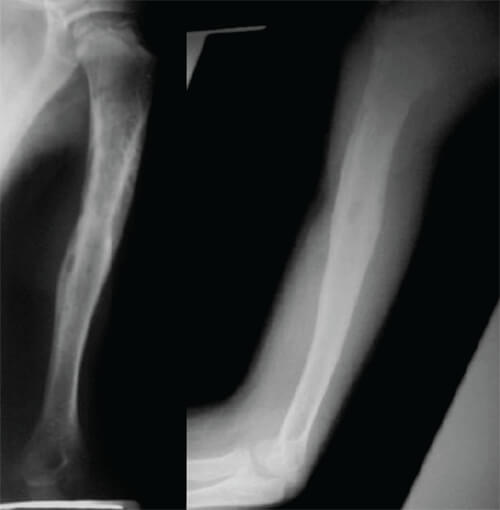
En la valoración imagenológica, se evidencia en la radiografía simple del húmero, en sus proyecciones anteroposterior y lateral panorámica, una lesión mal definida, en el tercio medio con proximal de la diáfisis, con patrón de destrucción ósea permeativo, asociado a neoformación perióstica de hueso en capas (Fig. 1).
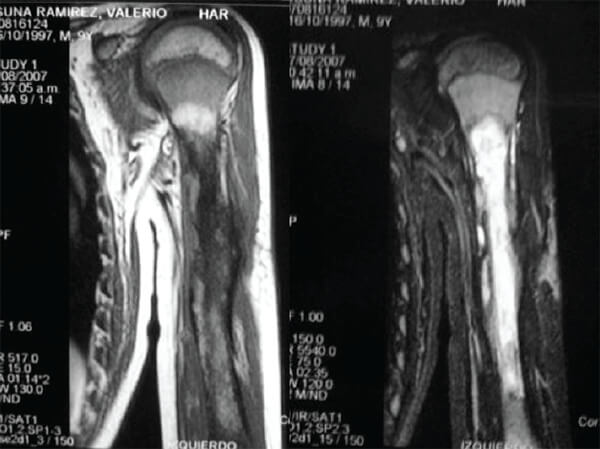
En Resonancia Magnética (RM) se observa patrón de destrucción ósea, restringida a la diáfisis, con extensión intramedular (Fig. 2).
En la gammagrafía ósea con Tecnecio 99, se observa hipercaptación en el tercio medio con proximal del húmero. No se evidencian otros focos de hipercaptación.
Los estudios de laboratorio reportaron elevación de la fosfatasa alcalina y la lactato deshidrogenasa.
Se realizó biopsia preoperatoria abierta (Hospital Universitario de Los Andes 28/02/2007 número 28- 07), que reportó “Sarcoma de Ewing”. La descripción histopatológica fue la siguiente: “Este tumor maligno está compuesto de acúmulos de pequeñas células redondeadas y azules, de citoplasma claro, con infiltración ósea, largas áreas de necrosis y figuras mitóticas” (Fig. 3). El estudio inmunohistoquímico (Laboratorio de Patología Molecular NOVATH, número 862-2007) reportó “Tumor en húmero izquierdo: Sarcoma de Ewing / PNET” (Fig. 3).

El diagnóstico fue confirmado en la Universidad de Yale (New Haven, EUA, reporte S07-4756) donde describen: “células neoplásicas positivas para CD99 de distribución membranosa y negativa para CD45 y desmina”, lo cual es consistente con el diagnóstico de Sarcoma de Ewing. El paciente recibió tratamiento por el servicio de oncología pediátrica.
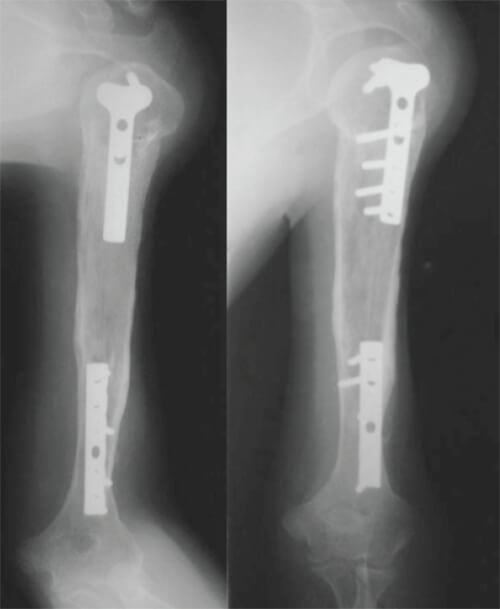
Con el diagnóstico establecido de Sarcoma de Ewing en húmero izquierdo. Estadío III, y con buena respuesta al tratamiento neoadyuvante, se decidió realizar la resección en bloque de la diáfisis del húmero clasificada como S45, de acuerdo al sistema de clasificación de resecciones de la Musculoskeletal Tumor Society (MSTS) (8) y su reconstrucción mediante la colocación de injerto óseo masivo estructurado de diáfisis de tibia, estabilizado con 1 placa en “T” de 3,5mm Ø (Synthes/AO, Oberdorf, Suiza) para el extremo proximal y 1 placa LC-DCP de 3,5mm Ø (Synthes/AO, Oberdorf, Suiza), para el segmento distal. Se utilizó un abordaje transdeltoideo que incluyó la cicatriz de la biopsia. El hueso fue resecado 3 cms proximal o distal a cualquier signo de afectación diafisiaria de acuerdo a la TC (Fig. 4, 5, 6).
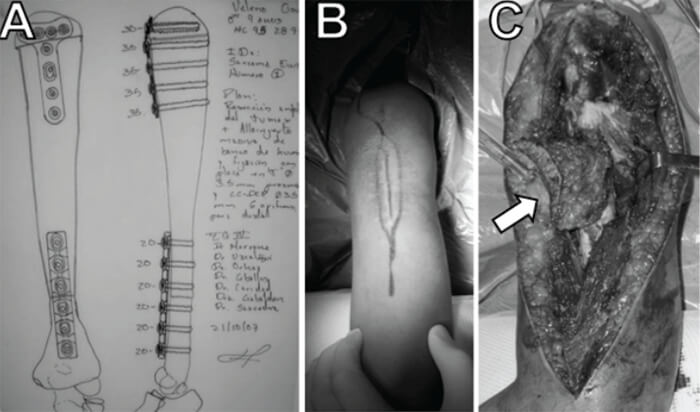
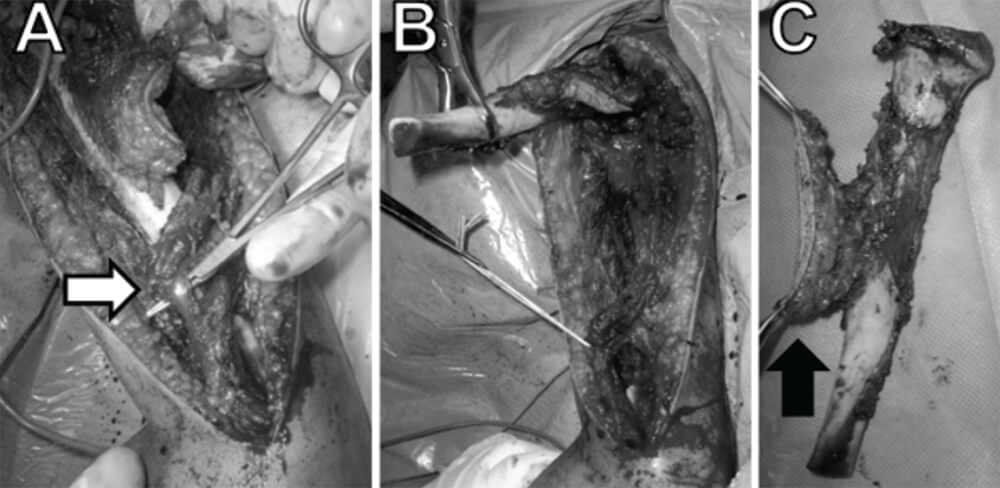
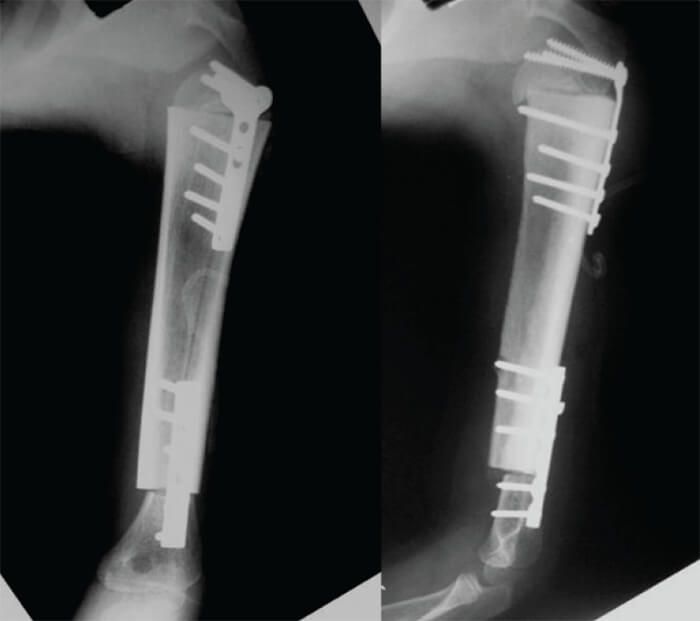
El paciente se mantuvo en hospitalización durante 30 días, posterior a lo cual fue egresado. Fue valorado cada 3 meses por nuestro servicio y el servicio de oncología pediátrica.
A fin de valorar la funcionalidad del aloinjerto, aplicamos la escala funcional de Mankin (9), la cual clasifica los resultados como: Excelentes, cuando no existe evidencia de enfermedad ni de dolor y hay una función normal y sin limitaciones (excepto para atletas de alta competencia); Buenos, cuando no hubo evidencia de enfermedad, modesta a moderada limitación de la función, sin dolor y no necesidad de soportes externos (tales como muletas o bastones) sin interferir con la ocupación laboral o estilo de vida normal, excepto para actividades deportivas; Regulares, cuando no tenían evidencia de enfermedad, aunque requieren algún soporte externo para deambular o presentaban dolor o limitación funcional que interfiera en su vida laboral y del hogar; y Malos, pacientes que precisaron la retirada del aloinjerto o la amputación del miembro o fallecieron como consecuencia directa de una recidiva local, siendo considerados como fracasos.
Por otro lado, para evaluar la osteointegración, usamos la escala ISOLS (International Symposium On Limb Salvage) que clasifica la unión aloinjerto-hueso en referencia al porcentaje de línea radiolucente visible radiográficamente mediante radiografía convencional de la siguiente manera: Excelente, línea de osteotomía no visible; Buena, unión mayor de 75% con una línea de osteotomía todavía visible; Aceptable, unión entre 25-75%; y Pobre, no se evidencia callo o unión menor de 25% (10).
En la valoración a 1 año del post operatorio se evidencia integración del aloinjerto, sin evidencia de recidivas locales y los controles de TC de tórax y gammagrafía no muestran metástasis o recurrencias. La valoración de acuerdo a la escala de Mankin fue buena, y según la escala ISOLS también fue buena.
A los 2 años del post operatorio, el paciente se mantiene libre de enfermedad sin recidivas locales o sistémicas. La valoración de acuerdo a la escala de Mankin se mantiene como buena y de acuerdo a la escala ISOLS el resultado es excelente. Igualmente se evidencia la “remodelación” del aloinjerto.
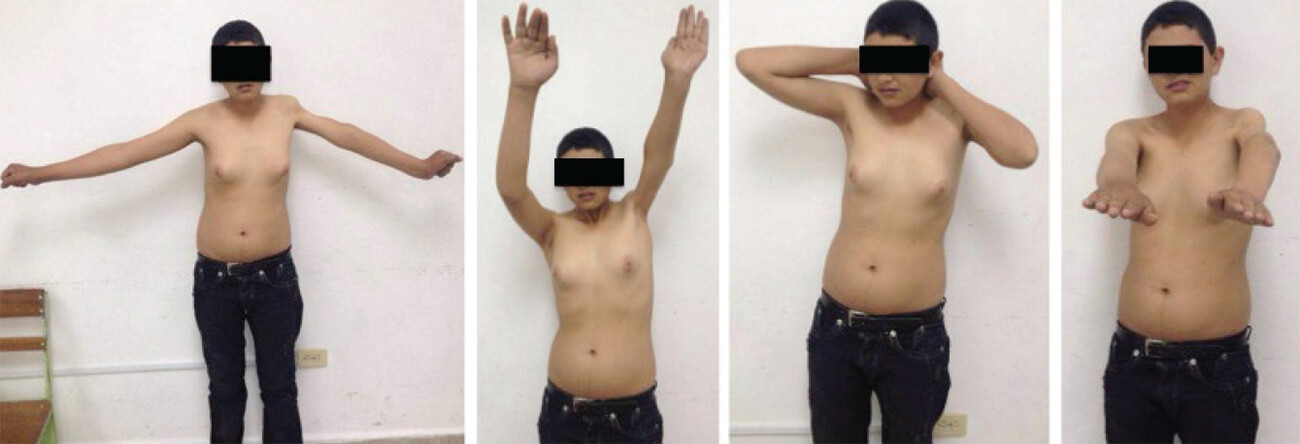
En la valoración a los 7 años del post operatorio el paciente se encuentra libre de enfermedad metastásica o recurencias, locales o sistémicas. De acuerdo a la escala de Mankin la funcionalidad es buena y a la escala ISOLS la osteointegración es excelente (Fig. 7 y 8).
El pronóstico del SE depende altamente en la evidencia clínica de enfermedad metastásica, que puede ser prevenible cuando se realiza detección temprana y tratamiento con control local agresivo de la enfermedad y quimioterapia multimodal sistémica (2,4,5,7).
El tercio proximal del húmero es una localización poco frecuente para los tumores óseos y aproximadamente 10% de los SE aparecen en este segmento, siendo el cuarto lugar más frecuente para este sarcoma (2,4).
Song, Kong, Jeon, Cho, Kim y Lee (11) señalan que antes de realizar la resección en bloque, el cirujano debe escoger el método de reconstrucción, si es biológico o nobiológico, teniendo en cuenta que los métodos biológicos de reconstrucción son considerados como una mejor alternativa en pacientes esqueléticamente inmaduros.
Según Wittig, Bickels, Kellar-Graney, Kim y Malawer(12), lo más importante en la cirugía de salvataje del húmero es maximizar el control local del tumor, y preservar la función tanto de la mano como del codo para mejorar la función del hombro y su estabilidad. Song y col (11) también indican que la correcta preparación del hueso receptor y la correcta selección del aloinjerto es importante para lograr una estructura estable, y que en general, usar aloinjertos de mayor diámetro que el hueso receptor es mejor, tal y como lo evidenciamos en nuestro caso.
Igualmente, el proceso de remodelación, mediante el cual ocurre la formación de continuidad entre la cortical del aloinjerto y del hueso receptor, que en nuestro caso puede definirse como “humerización del aloinjerto de tibia” se debe a que el poder regenerativo del hueso del niño es superior al del adulto según Song y col (12); quienes también refieren, que este proceso es favorecido por el uso de aloinjertos de mayor diámetro con lo cual se reduce la elevada incidencia de nounión, fracturas e infección observada en otras series (13,14).
En nuestro caso, no fue posible preservar la epífisis proximal del húmero, lo cual provocó que se presentara una discrepancia de longitud importante con respecto al brazo contralateral, ya que esta epífisis aporta aproximadamente el 80% del crecimiento longitudinal del húmero, sin embargo, esto no afectó los resultados alcanzados a largo plazo ni el confort del paciente (2).
Estudios como el de Park y cols (2), López y cols (7), Song y cols (12), Brigman y cols (13), Musculo y col (14), así como los resultados obtenidos a largo plazo con nuestro caso, demuestran que la resección en bloque y la reconstrucción con aloinjerto masivo en el tratamiento del SE en pacientes con enfermedad no metastásica, acompañado de quimioterapia coadyuvante, es la técnica de elección para el tratamiento de los sarcomas de los huesos largos hoy en día, proporcionando salvataje de una extremidad ante una lesión de esta magnitud, y sobre todo, mejorando la calidad de vida del paciente ante una expectativa de enfermedad altamente compleja.