Fecha de recepción: 21 Abril 2020
Fecha de aceptación: 15 Agosto 2020
El manejo de pseudoartrosis infectadas, osteomielitis y defectos óseos representa un reto enorme para el cirujano ortopedista. Hace diez años, Masquelet presentó la técnica de inducción de membrana como alternativa al manejo de las complicaciones mencionadas arriba con excelentes tasas de consolidación y erradicación del proceso infeccioso. Estudiamos una de serie de 14 casos, prospectiva, con seguimiento clínico y radiológico mínimo de 2 años (enero 2015-diciembre 2018), donde evaluamos múltiples variables en pacientes a quienes se les realizó el protocolo de Masquelet. Obtuvimos una tasa de consolidación de 85,7% (12/14). Con un tiempo promedio para alcanzarla de 6,1 meses (3-9m). Todos los pacientes que lograron la consolidación se encontraban libres de infección al final del seguimiento. Por su reproducibilidad y alta tasa de consolidación, consideramos la técnica de inducción de membrana, como una excelente opción en el manejo de pseudoartrosis infectadas complejas. Rev Venez Cir Ortop Traumatol, 2021, Vol 53(1): 10-19.
Palabras clave: Pseudoartrosis, injerto, fijación interna.
Nivel de evidencia:: II
The management of infected nonunions, osteomyelitis, and bone defects represents an enormous challenge for the orthopedic surgeon. Ten years ago, Masquelet presented the membrane induction technique as an alternative to the management of the complications afore mentioned with excellent rates of consolidation and eradication of the infectious process. We prospectively studied a series of 14 cases, with a clinical and radiological follow-up of at least 2 years (january 2015-december 2018). Where we evaluated multiple variables in patients who underwent the Masquelet protocol. We obtained a consolidation rate of 85.7% (12/14). With an average time to reach it of 6.1 months (3-9m). All patients who achieved union were free of infection at the end of follow-up. Due to its reproducibility and high consolidation rate, we consider the membrane induction technique an excellent option in the management of complex infected nonunions. Rev Venez Cir Ortop Traumatol, 2021, Vol 53(1): 10-19.
Key words: Pseudoartrosis, Graft, Internal Fixation.
Level of evidence: II
https://doi.org/10.55137/2021.53.1.002
Autor de correspondencia: Carlos Sánchez Valenciano, email: [email protected]
No existen conflictos de interés. Este trabajo fue realizado con recursos propios sin subvenciones.
Está ampliamente demostrado en la literatura científica que el manejo operatorio de las osteomielitis y pseudoartrosis infectadas de los huesos largos es altamente demandante, y generalmente se asocia a múltiples complicaciones, bajas tasas de consolidación y pobres resultados funcionales (1,2). En los últimos años hemos visto un aumento en las lesiones de alta energía; las mismas están directamente relacionadas con un incremento en la incidencia de las no uniones e infecciones mencionadas al inicio, sin embargo, vemos con preocupación que las mismas, también se presentan en casos de fracturas menos complejas que fueron manejadas pobremente, o con técnicas inadecuadas.
En 2010, Masquelet (3) presentó su protocolo en dos tiempos, que incluía, la resección amplia del hueso y tejidos comprometidos con la utilización de un espaciador de cemento óseo para rellenar inicialmente el defecto óseo creado, y luego en un segundo tiempo, el retiro del espaciador y el relleno de
la membrana biológica neoformada alrededor del espaciador con injerto óseo autólogo. La membrana biológicamente activa ha sido sujeto de múltiples estudios que confirman sus propiedades osteoinductivas.
Este trabajo tiene como objetivo presentar nuestra experiencia en el manejo de 14 pacientes consecutivos con diagnóstico de osteomielitis o pseudoartrosis infectadas, que fueron tratados según la Técnica de Inducción de Membrana.
Presentaremos las características demográficas asociadas a los pacientes, describiremos en detalle las dos fases asociadas con el protocolo operatorio, expondremos nuestros resultados de consolidación, y revisaremos la literatura publicada en relación al tema.
Se realizó un estudio prospectivo, multicéntrico y descriptivo. Se incluyeron todos los pacientes, de ambos sexos, mayores de 18 años con sospecha clínica de osteomielitis o pseudoartrosis infectadas, que acudieron o fueron referidos a la consulta del autor de la investigación, desde enero de 2015 a diciembre de 2018. A cada paciente se le realizó la evaluación clínica, paraclínica y radiológica de infecciones músculo-esqueléticas, de acuerdo con los protocolos expuestos por Parvizi (4,5).
Los criterios de exclusión fueron pacientes menores de 18 años, con patologías tumorales óseas, y aquellos quienes se negaron a cumplir un protocolo en dos tiempos. Todos los pacientes firmaron un formulario de consentimiento informado obligatorio para participar en esta investigación.
Se consideraron criterios de infección: presencia de una fístula osteocutánea, o la obtención del mismo germen, cultivado en dos tomas distintas de muestras de tejidos o fluidos del área sospechosa. Se tomaron en cuenta los parámetros de contaje leucocitario, Velocidad de Sedimentación Globular (VSG) y Proteína C reactiva (PCR). Para el diagnóstico imagenológico de pseudoartrosis e infección, se solicitó a todos los pacientes radiografías simples del miembro afectado, en proyecciones ortogonales y oblicuas, y una Resonancia Magnética de la extremidad, buscando signos de ausencia de consolidación, e indicadores de infección ósea agudos o crónicos (6). Todos los pacientes fueron referidos con solicitud de interconsulta al servicio de infectología.
Se estableció un tiempo mínimo de seguimiento de 2 años.
Una vez incluidos en el estudio, a cada paciente se le realizó una historia clínica, se completaron los exámenes preoperatorios, y adicionalmente se les solicitó, en caso de que estuviesen tomando tratamiento antibiótico, suspenderlo al menos 7 días antes del momento del inicio del protocolo quirúrgico.
Previa asepsia y antisepsia de la zona operatoria, sin utilización de torniquete neumático, se realizó abordaje quirúrgico, y se inició el desbridamiento extenso con toma de muestras de cualquier tejido sospechoso de infección (más de 4 muestras), en los casos necesarios, se realizó retiro de material de síntesis previamente colocado. Al momento de la realización de la osteotomía de resección, se tomaron en consideración las características macroscópicas de hueso, así como el signo de Paprica (7), y se procedió a colocar 2 alambres de Kirschner, estimando dejar un margen sano de uno a dos centímetros, tanto proximal como distalmente (Figura 1). Se procedió a realizar la osteotomía con sierra oscilante, con irrigación continua de solución salina, durante todo el proceso de cortes óseos. Se tomaron muestras adicionales de hueso proximal y distal a la resección ósea, y a partir de ese momento se instruyó al equipo de anestesiología a cumplir dosis de antibiótico de amplio espectro.
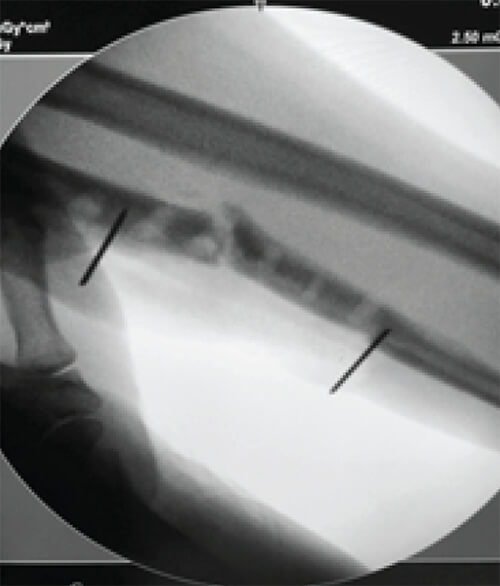
Se tomó la medida longitudinal del defecto post osteotomía, y se procedió a realizar el lavado definitivo con solución povidonada al 1,3% (8). Posteriormente, se procedió a la colocación de los pines proximales y distales del fijador externo (FE) a utilizar, en posición provisional, el cual se ajustaría a su posición definitiva una vez colocado el espaciador de cemento óseo. Se confeccionó el espaciador de cemento óseo con antibiótico, utilizando 4 gramos de Vancomicina por cada Unidad de polimetilmetacrilato (PMMA).
Primero se realizó el moldeado en la mesa de la instrumentista, colocándole en su núcleo un alambre de Steinmann de la misma longitud del defecto óseo; luego cuando el fraguado estaba en proceso, se procedió a colocarlo entre los fragmentos óseos proximal y distal, irrigándolo de manera continua. Adicionalmente se prepararon dos medallones de PMMA, para ser colocados a manera de abrazaderas, en comunicación con los extremos óseos y el espaciador de cemento, esto último con el fin de favorecer la formación de la membrana desde hueso sano, y evitar que la misma se ubicara en la interfase hueso sano-cemento óseo (Figura 2).
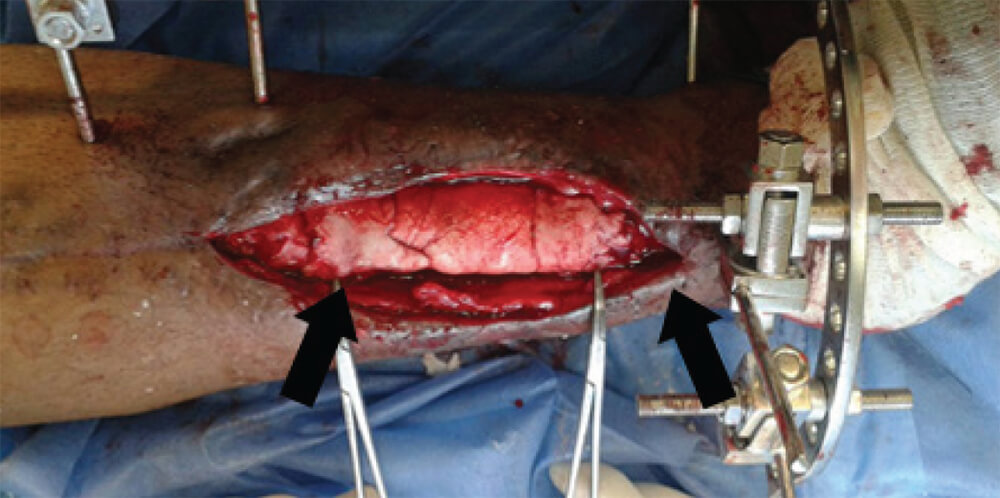
Se ajustó el FE a su posición definitiva, y posteriormente se realizó síntesis por planos con sutura monofilamento. Por último se colocó vendaje blando en la extremidad.
Los pacientes permanecieron hospitalizados entre 24 y 72 horas, cumpliendo antibioticoterapia endovenosa empírica a cargo del servicio de infectología. Al tener el resultado del cultivo, se decidió el egreso del paciente con antibioticoterapia especifica, según el antibiograma obtenido. Se realizaron curas a las 48 horas, 7, 14 y 21 días. Se realizaron controles de Hematología, PCR cuantitativa y VSG, en el postoperatorio inmediato, y luego a las 2, 4 y 6 semanas de tratamiento antibiótico ambulatorio. Posteriormente, entre la 4ta y la 6ta semana del tratamiento antibiótico, según la bacteriología de cada paciente, se suspendió la administración de antibióticos y el paciente permaneció sin tratamiento durante dos semanas, en ese momento se realizaron controles de Hematología, PCR y VSG. Sólo se procedió a realizar segundo tiempo quirúrgico de técnica de inducción de membrana, en aquellos pacientes con cicatrización completa, ausencia de fístula, o manifestaciones clínicas locales o sistémicas de infección, y que además tuvieran PCR cuantitativa negativa, luego de las mencionadas dos semanas sin antibioticoterapia.
Sin la utilización torniquete neumático y previo retiro del FE, se realizó el abordaje en el área de cicatriz previa. Sobre la membrana se realiza incisión con bisturí frio. Se procedió al retiro del espaciador de cemento con antibiótico, y se tomaron muestras para cultivo y antibiograma de hueso proximal, hueso distal y de la capa interna de la membrana biológica.
Se preparó el injerto tomado de crestas iliacas, retirando las adherencias fasciales y con la utilización de una gubia, se morcelizó en fragmentos de 3 a 5 mm de diámetro. Una vez realizada la osteosíntesis, se procedió a colocar el injerto óseo de manera uniforme dentro de la membrana de manera que presentara contacto con los fragmentos proximales y distales, distribuyéndolo con soltura dentro de la membrana (Figura 3). Posteriormente se realizó el cierre de la membrana biológica con puntos separados con sutura monofilamento, en un solo plano el tejido subcutáneo y la piel de manera similar. Se preparó una inmovilización según la extremidad.
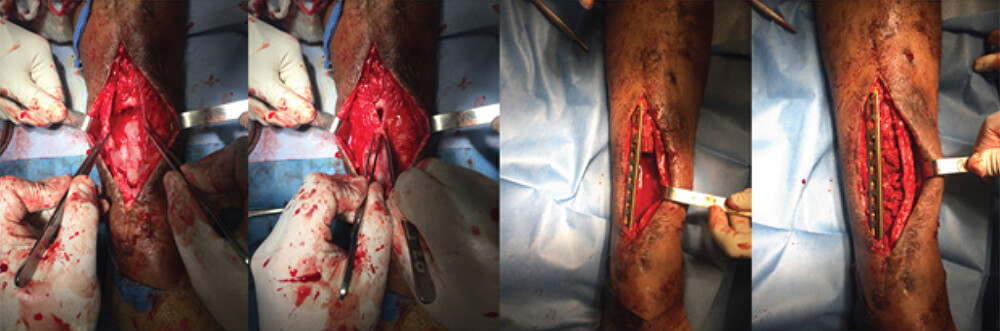
Los pacientes permanecieron hospitalizados entre 48 y 72 horas, recibiendo tratamiento antibiótico endovenoso específico para el germen aislado en el primer tiempo quirúrgico, hasta la obtención de los resultados del nuevo cultivo y antibiograma; cuando no hubo crecimiento bacteriano, los pacientes egresaron sin antibioticoterapia vía oral; los casos en los que si hubo, se manejó el protocolo según el antibiograma por infectología, agregando en esos casos, cobertura antibiótica anti-Biofilm luego de la segunda semana, hasta cumplir seis semanas. Se realizaron controles para cambios de cura, y evaluación de las partes blandas a los 7 y 14 días; los controles radiológicos se realizaron mensualmente, hasta evidenciarse signos radiológicos de consolidación proximal y distal, así como calcificación y corticalización del injerto óseo. Se realizaron controles de hematología, VSG y PCR en el postoperatorio inmediato, al mes y luego a la 6ta semana, momento de terminar el tratamiento antibiótico, y se repitió por última vez el PCR, dos semanas posteriores a la finalización de la antibioticoterapia. Se permitió realizar actividades de carga de peso luego de evidenciar signos de consolidación completa.
Todos los pacientes realizaron rehabilitación y medicina física acorde a la extremidad en tratamiento, sexo y edad, así como nivel de actividad física previo a la lesión, y expectativas de actividad física post tratamiento. Luego de finalizado el protocolo, se agendaron controles cada seis meses hasta completar los dos años de seguimiento.
Los datos obtenidos en las distintas fases del trabajo fueron vaciados en un formulario creado para tal fin y fueron procesados con el programa Excel (Microsoft) y SPSS 18.0 (IBM) y presentados en tablas.
Se incluyeron 14 pacientes, con edades comprendidas entre los 23 y los 70 años. El promedio de edad fue de 39,6 ± 16,02 (23-70) años, 8/14 (57,15%) de sexo masculino y 6/14 (42,85%) femeninos. Se manejaron 8/14 (66,6%) tibias, 3/14 (25%) tobillos (articulación tibio-peroneo-astragalina) 1/14 (8,3%)fémur, 1/14 (8,3%) radio y 1/14 (8,3%) cúbito.
El promedio de los defectos óseos, producidos al momento de realizar el desbridamiento quirúrgico durante el primer tiempo de la técnica fue de 10,9 ± 2,61 (7-16) cms, con longitudes que oscilaron entre los 7 cms. en el cúbito de un paciente femenino, hasta 16 cms. en dos tibias de las estudiadas. Se documentó también, el tiempo transcurrido desde el inicio de las complicaciones infecciosas músculo-esqueléticas relacionadas con la lesión o los procedimientos previamente realizados, y la atención en nuestra consulta, evidenciándose que el promedio de espera para consultar fue de 25,7 ± 12,9 (3-56) semanas, en otras palabras, un período ligeramente superior a 6 meses. Adicionalmente se observó un promedio de 2,3 ± 0,84 (1-4) cirugías realizadas en la extremidad afectada antes de acudir a nuestra consulta.
En todos los pacientes incluidos en el estudio con diagnóstico de osteomielitis o pseudoartrosis infectadas, se obtuvieron cultivos intraoperatorios positivos tomados de los tejidos sospechosos durante el primer tiempo del protocolo, el 85% presentó infecciones monomicrobianas, y un 15% infecciones con dos o más gérmenes. El Stafilococus aureus fue aislado en el 41,6%
de los pacientes con infecciones monomicrobianas, así mismo estuvo presente en uno de los dos individuos con infecciones polimicrobianas; la segunda bacteria más frecuente fue la Escherichia coli (3 pacientes) representando el 25% de las infecciones por un solo germen, seguido por el S. epidermidis aislado en 2 pacientes. El resto de los patógenos obtenidos en nuestra investigación fueron: Pseudomona areuginosa, Salmonella spp, Ac. Baumanii, Streptococospp, S. Haemolyticus, respectivamente. Sólo cuatro pacientes presentaron cultivos positivos durante el segundo tiempo quirúrgico, de ellos, dos fracasaron en el protocolo, y tuvieron recidiva del proceso infeccioso, con ausencia de consolidación.
El tiempo promedio de espera, entre el primer y segundo procedimiento de la técnica para la formación de la membrana alrededor del espaciador de cemento óseo fue de
11,53 ± 8,22 (6-36) semanas, lo que se traduce aproximadamente en una espera aproximada de 3 meses entre el procedimiento inicial y el definitivo.
En relación al número de procedimientos quirúrgicos realizados, en 8/14 (57,15%) pacientes no se requirieron cirugías adicionales, sin embargo, se realizaron un total de 11 procedimientos extras, que incluyeron, colgajos e injertos cutáneos, limpiezas quirúrgicas, una repetición del primer tiempo por desplazamiento del espaciador de cemento, puesto que el paciente apoyó la extremidad en cuestión, y se propuso realizar una amputación supracondílea por fracaso de la técnica, con recidiva de la infección y severo daño de partes blandas, sin embargo, la paciente no lo aceptó esa propuesta (Figura 4).
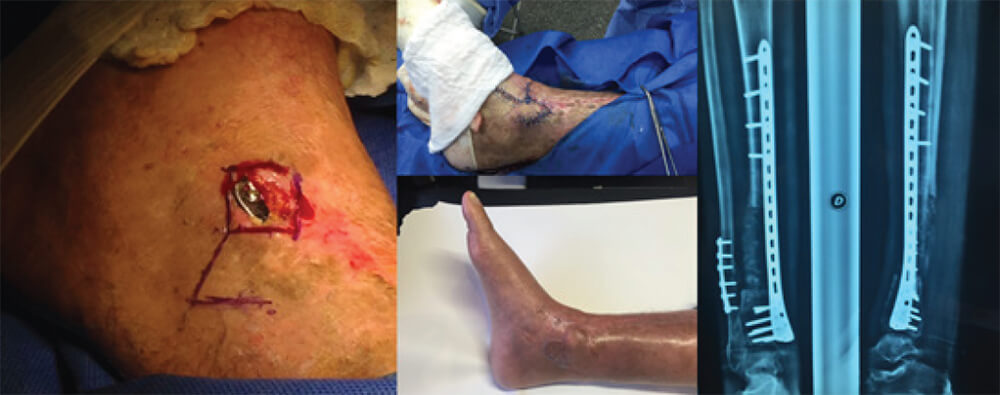
En lo que se refiere al material de síntesis utilizado para estabilizar de manera definitiva la pseudoartrosis con defecto óseo relleno de chips de autoinjerto de cresta ilíaca introducidos dentro de la membrana neoformada, los dispositivos extramedulares fueron mayormente utilizados, con un total de 10 (71,5%) osteosíntesis realizadas con placas, una de las cuales requirió un doble plaqueado. Se colocaron dispositivos endomedulares, en 4 (28,5%) pacientes.
La tasa de consolidación clínica con confirmación radiológica obtenida durante nuestro protocolo fue de 12/14 (85,7%) pacientes, con inicio de marcha y/o carga de peso en la extremidad afectada en promedio a los 6,1 ± 1,69 (3-9) meses posteriores a la segunda intervención descrita en el protocolo (Figura 5).
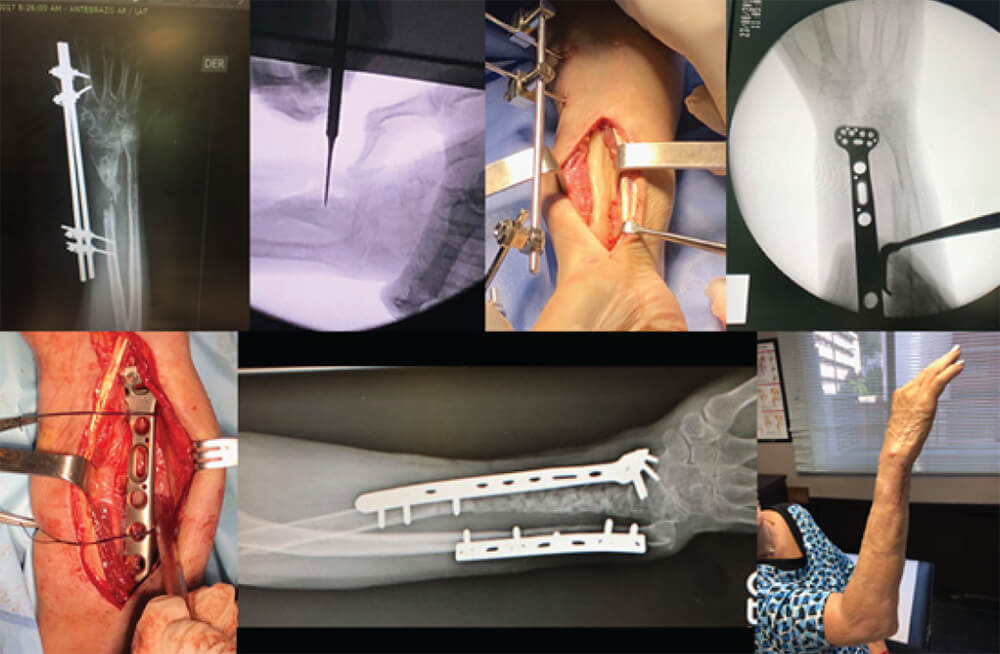
La tasa de complicaciones fue del 14,28 %. 2 pacientes no consolidaron, y fueron considerados como fracasos en este protocolo, en ambos reaparecieron signos clínicos y paraclínicos de infección en la extremidad afectada.
En su trabajo original el Dr. Masquelet (3), planteó que al realizar su protocolo en dos tiempos quirúrgicos para el manejo de pseudoartrosis infectadas, obtuvo una tasa de consolidación del 90%, 10 de 11 pacientes pudieron caminar sin asistencia en un tiempo promedio de 11,5 meses. Nuestros resultados coinciden con lo presentado en el párrafo previo, tomando en consideración que obtuvimos aproximadamente un 86% de consolidación de 14 pacientes, y el tiempo promedio para inicio de descarga o carga de peso ligeramente superior a meses 6.
Cuando analizamos nuestros resultados en relación al tiempo de consolidación, encontramos que los pacientes a quienes se les realiza el procedimiento para defectos óseos en el miembro superior parecieran tener un tiempo menor de consolidación que a quienes se les realiza en tibia o en fémur, esto pudiera estar condicionado porque en los miembros inferiores, el volumen de injerto necesario es generalmente mayor, y por ello requiere más tiempo para su integración y osificación.
Así mismo, aunque no podemos demostrar evidencia estadística, observamos que en los pacientes en quienes se utilizó como método de fijación definitivo un implante intramedular (Clavo bloqueado) presentaron tiempos de consolidación e inicio de apoyo, menores que aquellos en quienes se utilizaron osteosíntesis extramedulares; a nuestro juicio, las dos ventajas principales del enclavado endomedular, son que al tratarse de un dispositivo centro medulares biomecánicamente ideal para el inicio del apoyo precoz, y adicionalmente, ocupa un volumen dentro de la membrana biológica, específicamente en la porción central de la misma, lo que disminuye la cantidad de injerto necesario para ocupar el resto del espacio del defecto óseo, es por ello que en nuestra práctica reciente preferimos el uso de enclavado endomedular para el manejo de estos defectos diafisiarios, y dejamos la fijación extramedular para aquellos defectos óseos periarticulares o transarticulares, en los que podemos beneficiarnos de la versatilidad de las placas de bloqueo.
Nuestra serie de casos reportó como longitud promedio de defecto óseo aproximadamente 109 mm, esto contrasta con los resultados presentados por Vejarano-Solano, cuyo promedio fue de 74 mm, y coinciden con los resultados del trabajo original del Dr. Masquelet, quien presentó una media de defectos óseos de 105 mm. Lo previamente descrito cobra vital importancia cuando consideramos que, en una revisión posterior de su técnica, con trucos y perlas de la misma, presentada en el año 2015 (10), se plantea que la única manera de poder erradicar la infección es retirar todo el tejido óseo afectado, dejando márgenes sanos, que pueden ser evidenciados a través del signo de Paprika. No podemos dejar de hacer énfasis en que una resección ósea insuficiente durante el primer tiempo de desbridamiento, es probablemente, el factor más importante para el fracaso de este protocolo.
La bacteriología encontrada en nuestra serie de casos, coincide con la reportada en la literatura científica (9, 11,12), el S. aureus fue el germen mayormente aislado en nuestra serie, estando involucrado en el proceso infeccioso de 6 de los 14 pacientes evaluados. Es importante destacar, que según el protocolo original del Dr. Masquelet, la decisión de iniciar el segundo tiempo quirúrgico, estaba apoyada, en estudios de laboratorio, imagenológicos y biopsias de tejido, para confirmar la erradicación del proceso infeccioso, sin embargo, nosotros no realizamos, en ninguno de los casos, biopsias de tejido posterior al tratamiento antibiótico propuesto por infectología. Basamos nuestras decisiones en parámetros clínicos y paraclínicos, dándole especial importancia al valor cuantitativo de PCR. La biopsia es sin duda una excelente herramienta para confirmar o descartar la persistencia de la infección, pero en nuestro medio pudiera condicionar un aumento significativo de los costos del protocolo.
Estudios histopatológicos (13,14) confirman que la membrana biológica, no sólo actúa como una cubierta protectora para mantener el injerto morcelizado de cresta ilíaca en su posición, sino que además sus capas más profundas, son altamente activas en la producción y liberación de factores estimulantes y promotores de la osificación, como lo son el VEGF, el vWF, el TGF B1 y la BMP-2, cuyos valores máximos se observan entre la 2da y la 4ta semana (14). Es por lo anterior, que se trata en la medida de lo posible, que el período entre el primer y segundo procedimiento no sea superior a las 6 semanas, tiempo suficiente para poder cumplir la antibioticoterapia propuesta según los cultivos, y aprovechar el efecto beneficioso de las altas concentraciones de los factores osteoinductores mencionados. Sin embargo, en nuestra serie presentamos un caso de un paciente masculino de 26 años, con una pseudoartrosis infectada de fémur distal, quien debió esperar 9 meses entre el primer y el segundo procedimiento del protocolo, consolidando sin ninguna complicación dentro del rango del tiempo previsto según nuestra casuística. Ello pareciera indicar que la actividad biológica de la membrana, a pesar de disminuir luego de la 4ta semana, no desaparece por completo con el paso del tiempo.
No todos los estudios con técnica de inducción de membrana han reportado resultados satisfactorios, de hecho, Morris y col. (15) concluyen que la técnica de Masquelet no es efectiva para el manejo de defectos óseos complejos complicados con infecciones, reportando una tasa de fracasos de aproximadamente el 60%, sin embargo, al analizar metodológicamente ese estudio, encontramos errores técnicos que pudieron afectar los resultados. En ese orden de ideas, se hace necesario citar el trabajo de la Dra. Morelli, (16) una revisión sistemática y metaanálisis, que reportó tasas de unión y de cura de infección de 89,7% y 91%, respectivamente y una tasa de fracasos de 18%, que según los autores, puede ser debido a la gran variedad de variantes de la técnica que se observan en la literatura, en términos de tiempo, del tiempo del espaciador, y antibioticoterapia, utilización de sistemas de aspiración e irrigación endomedular, técnicas de desbridamiento, utilización de sustitutos óseos, etc., es por esta razón que el autor principal, recomienda seguir la metodología descrita previamente, de la manera más estricta posible.
Otro factor a considerar, según nuestra experiencia, es la necesidad de realizar un procedimiento secundario, para complementar la técnica de 2 tiempos; en la serie presentada, un poco más del 40% de los pacientes requirieron algún procedimiento adicional, así que el cirujano, debe dominar los conocimientos, y ser capaz de realizar técnicas de reconstrucción de miembros, como colgajos miocutáneos e injertos de piel, según sea necesario. Preferiblemente, recomendamos realizar los mismos, en la menor cantidad de cirugías posibles, puesto que en esta serie encontramos relación directamente proporcional entre el número de procedimientos adicionales realizados, y la ocurrencia de fracaso (no unión o persistencia de la infección).
Se puede concluir que la técnica de Masquelet es una opción viable, reproducible y que puede brindar resultados satisfactorios en términos de tasas de consolidación y erradicación del proceso infeccioso en pacientes con patología óseas complejas como lo son la osteomielitis y/o pseudoartrosis infectadas en miembros superiores e inferiores. Es importante cumplir el protocolo de la manera más estricta posible, puesto que al tratarse de pacientes de alta complejidad, y que han sido sometidos a múltiples intervenciones previas, los fracasos suelen ser devastadores. Dado el tamaño limitado de nuestra muestra, no se pueden sacar conclusiones estadísticas de amplio alcance. Sin embargo, la mayoría de la literatura revisada cuenta con reportes similares. Se recomienda la utilización de dispositivos endomedulares como método de fijación definitiva para los pacientes en quienes se realizó la técnica en sus miembros inferiores, para disminuir el tiempo de consolidación e iniciar el apoyo de manera precoz.